Komentar: Ovo je 9. poglavlje knjige gosp. Lescaudrona "Masovna izumiranja, evolucijski skokovi i povezanost virusa i informacija".
Prethodno poglavlje: Poglavlje 8.: Saltacionizam protiv darvinizma
Prvo poglavlje: Poglavlje 1.: Masovna izumiranja
Poglavlje 9: Enigma specijacije
Zaključili smo poglavlje pod naslovom "Ostale eksplozije života" sljedećom izjavom: gore navedeno sugerira da veliki udari kometa nisu samo destruktivni činovi koji uklanjanju zastarjele oblike života tijekom masovnih izumiranja, već su to i kreativni činovi kroz uvođenje složenijih oblika života. Ali koji je to mehanizam koji je iznad ovih iznenadnih životnih eksplozija?
Začudo, dugo vremena ova neobičnost nije privlačila veliku pozornost znanstvene zajednice:
[...] izumiranje dinosaura i mnogih drugih skupina životinja na granici između krede i tercijara (KT) bila je posljednja od šest velikih epizoda masovnog izumiranja identificiranih oko 1960. iz fosilnog zapisa, a one ranije (kronološkim redom) bile su blizu ili na kraju razdoblja kambrija, ordovicija, devona, perma i trijasa. Međutim, vrlo malo evolucijskih biologa ili paleontologa (istraživača fosila) vidjelo je ikakav razlog za mišljenje da je za te događaje potrebno posebno objašnjenje. Do tog vremena, moderna sinteza, koja spaja tradicionalni darvinizam s populacijskom genetikom, postala je nadmoćno dominantna evolucijska paradigma, i vjerovalo se da se cijeli tijek života na Zemlji može objasniti kroz mehanizam adaptivne mutacije.[1]Darvinisti evolucijske skokove uvjetno objašnjavaju prazninom ekoloških niša koje omogućuju pojavu novih vrsta. Taj se teorijski proces naziva adaptivna radijacija[2]. Tvrdi da oslobađanje od konkurencije izazvano masovnim izumiranjem omogućuje evolucijske skokove koji slijede.
Ako je smanjena konkurencija doista bila pokretač evolucijskih skokova, što je masovno izumiranje bilo gore, to je konkurencija postajala manja i, prema tome, evolucijski skok bi trebao biti veći. Ali to uopće nije tako:
[N]ema vidljive veze između veličine izumiranja i njegovog ekološkog ili evolucijskog utjecaja.[3]Zapravo, podaci paleontologa pokazuju da konkurencija, ili nedostatak iste, ne igra nikakvu ulogu u nastanku novih vrsta ili u izumiranju postojećih:
Podaci iz dubokog mora pokazuju da su nastanak i izumiranje vrsta pojedinačni događaji koji nisu povezani s drugim vrstama u istom okolišu. Konkurentska zamjena (sposobnija vrsta koja izlazi iz rubnog okoliša i nadmašuje uspostavljenu vrstu) se općenito ne opaža.[4]Može se ostaviti bakteriju u bilo kojem okruženju na neograniöeno vrijeme; natjecanje ili ne, to neće dovesti do trilobita. Ovo je dodatno ilustrirano prethodno spomenutom smiješno niskom vjerojatnošću[5] pojave čak i najjednostavnije stanice. Prazan ekološki prostor ne može objasniti iznenadno pojavljivanje novih i složenijih vrsta, koje su, barem u nekim slučajevima, lišene ikakvih poznatih predaka. Dok konkurentska zamjena može imati marginalnu ulogu u nekim slučajevima, to nije dovoljno, i očito nešto nedostaje.
Prema nedavnim istraživanjima, masovna izumiranja doista omogućuju naknadne evolucijske skokove:
Ne može se poreći duboki evolucijski poticaj koji su masovna izumiranja dala povijesti života. Masovna izumiranja stvaraju nove evolucijske prilike i preusmjeravaju tijek evolucije.[6]Ali kako masovna izumiranja (čin uništenja) mogu omogućiti životnu eksploziju (čin stvaranja) ako ne kroz Darwinovu kompetitivnu zamjenu? Prema engleskom biokemičaru i evolucionistu Trevoru Palmeru, odgovor leži u genetici:
[...] razvoj genetike sugerirao je da bi masovna izumiranja mogla učiniti više od stvaranja praznog ekološkog prostora za radijaciju novih vrsta. Čini se jasnim da stres može dovesti do hipermutacija i također do epigenetskih promjena, pa se mora smatrati mogućim da bi katastrofalna epizoda masovnog izumiranja mogla dovesti do niza varijanti izvan onoga što bi se vjerojatno dogodilo tijekom normalnih vremena.[7]Što bi mogao biti uzrok gore spomenutih "hipermutacija" i "epigenetskih promjena" koje dovode do pojave novih vrsta?
Usput rečeno, evolucijski skokovi uočeni nakon masovnih izumiranja zahtijevaju ne samo "hipermutacije" kao što je navedeno u gornjem citatu, već i korisne hipermutacije koje omogućuju iznenadnu pojavu ne samo novih već i složenijih, organiziranijih oblika života. Što bi moglo uzrokovati te temeljne i korisne promjene?
Pojava novih i složenijih vrsta nakon masovnih izumiranja izazvanih kometama je ponavljajući obrazac. Ovaj nastanak novih vrsta naziva se "specijacija", proces koji je opažen u stvarnom vremenu, u samo jedne životinje[8]: australskog žutonogog stijenskog valabija.
Trenutno, reorganizacija retrovirusa u genomima dovodi do rađanja nove vrste:
Godine 2001., O'Neill i njezini kolege su pokazali kako retrovirusi koji nastanjuju centromere kromosoma hibridnih australskih stijenskih valabija stvaraju nove vrste opsežnim žongliranjem kromosomskih fragmenata.[9]Ova hipoteza virusne specijacije izložena u gornjem citatu uklapa se u tezu Trevora Palmera prema kojoj je specijacija potaknuta "hipermutacijom" i "epigenetskim promjenama". Doista, poznato je da virusi igraju veliku ulogu u epigenetici:
Smatra se da virusi koji inficiraju životinjske stanice igraju središnju ulogu u oblikovanju epigenetskog scenarija zaraženih stanica. U tom kontekstu postalo je očito da će poznavanje utjecaja koji virusne infekcije imaju na epigenetsku kontrolu njihovih stanica domaćina sigurno dovesti do boljeg razumijevanja međudjelovanja virusa sa životinjskim stanicama.[10]Isto tako, virusi su glavni uzrok "hipermutacija" u genomima domaćina kroz najmanje tri procesa:
1) Integracija virusnog genoma u genom domaćina, fenomen također poznat kao integracija virusnog genoma. Ova integracija je neophodan korak[11] za sve retroviruse, a događa se i kod drugih virusa, uključujući neke uobičajene kao što su hepatitis B[12], humani herpes[13] (HHV-6) ili Epstein Barr[14] virusi.
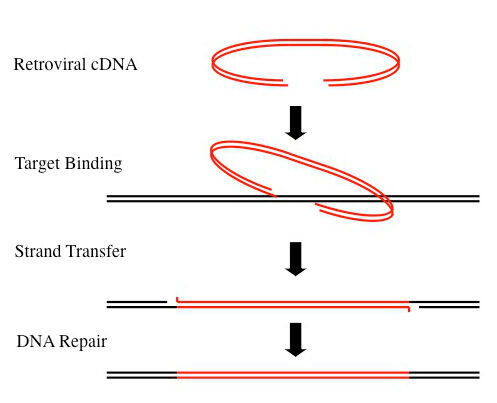
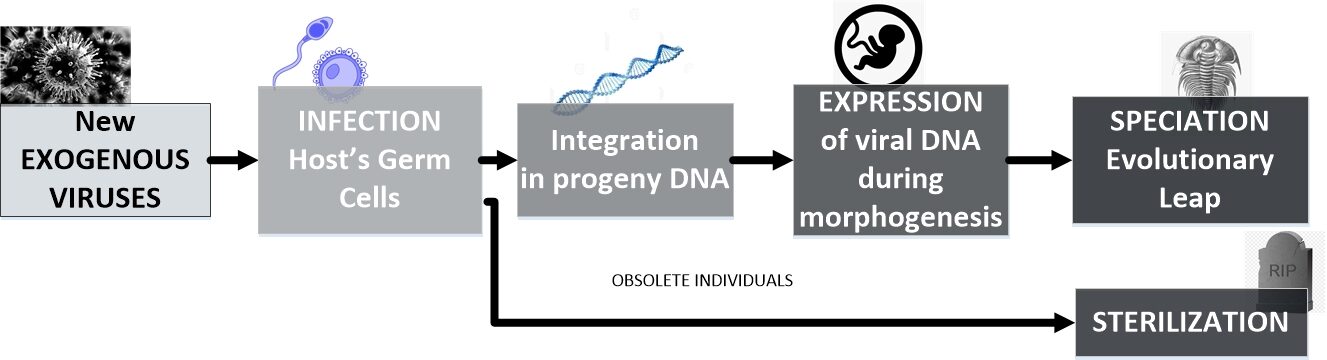
Ilustrirajmo integraciju virusnog genoma pomoću primjera. Određena životinja izložena je novom virusu koji se prenosi zrakom, vodom ili drugim živim bićima. U tom trenutku, za tu životinju, virus je egzogeni virus. Ako se virusna infekcija i integracija dogodi u germinalnoj liniji ovog domaćina, virusna sekvenca će postati dio DNK njegovog potomstva, te je egzogeni virus postao endogeni virus i od sada je on nasljedna virusna sekvenca integrirana u genom potomaka domaćina. Ova integracija virusnih genetskih sekvenci u DNK domaćina de facto modificira DNK domaćina kao što je prikazano na sljedećoj ilustraciji:
2) nakon što se virus integrira, može dalje mijenjati genom domaćina kroz brojne modifikacije među kojima su duplikacija[15], brisanje[16], replikacija[17] i rekombinacije žarišta[18].
3) virusne sekvence umetnute u genom domaćina modificiraju ekspresiju ovog genoma; drugim riječima, one uključuju i isključuju postojeće gene[19] genoma domaćina. O ovoj će točki biti riječi na sljedećim stranicama.
Zapravo, modifikacije genoma domaćina izazvane virusom su toliko duboke da mogu dovesti do fundamentalno suprotnih rezultata: smrti s jedne strane ili evolucije s druge strane, ovisno o domaćinu. Ova dvojnost podsjeća na scenarije ponavljajućih masovnih izumiranja u kojima se zastarjele vrste suočavaju sa smrću, dok se one koje su pošteđene razvijaju:
Nakon infekcije stanica, neki virusi integriraju svoj genom u kromosom domaćina, bilo kao dio svog životnog ciklusa (kao što su retrovirusi) ili slučajno. Iako može promicati dugotrajnu postojanost virusa u stanici, integracija virusnog genoma također može dovesti do drastičnih posljedica za stanicu domaćina, uključujući poremećaj gena, insercijsku mutagenezu i smrt stanice, kao i doprinos evoluciji vrste.[20]Specijacija koja je u tijeku među valabijima nije jedini slučaj pojavljivanja novih oblika života izazvanih virusnim sekvencama. Sama pojava roda homo (ljudi) također je povezana s virusnom aktivnošću:
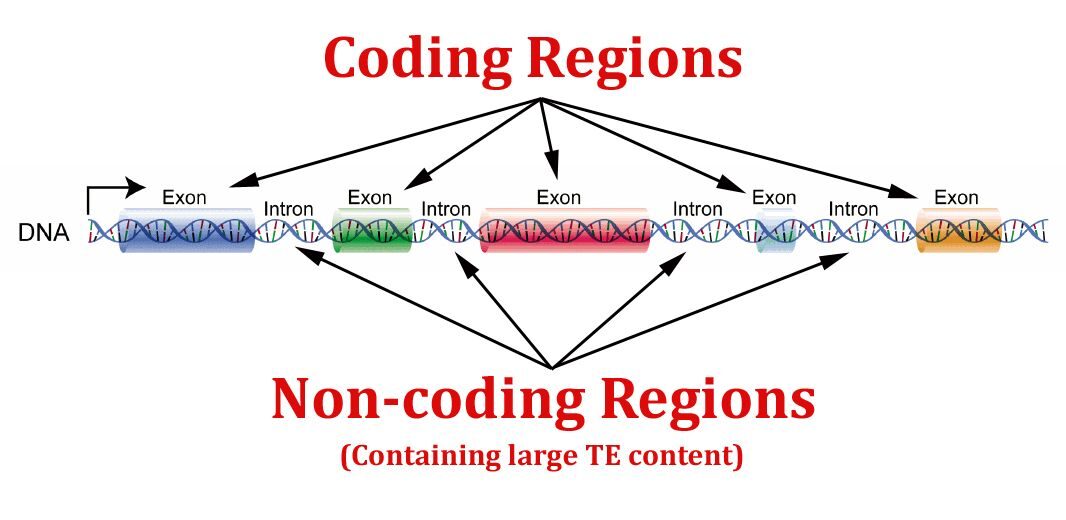
Ljudi dijele oko 99% svoje genomske DNK sa čimpanzama i bonoboima; prema tome, razlike između ovih vrsta vjerojatno nisu u sadržaju gena, već mogu biti uzrokovane naslijeđenim promjenama u regulatornim sustavima. Endogeni retrovirusi (ERV) čine ~5% ljudskog genoma. LTR-ovi ERV-a sadrže mnoge regulatorne sekvence, kao što su promotori, pojačivači, poliadenilacijski signali i mjesta vezanja faktora. Stoga mogu utjecati na ekspresiju obližnjih ljudskih gena. [...] Vjerojatno je da su se neki od tih ERV-ova mogli integrirati u regulatorne regije ljudskog genoma, te su stoga mogli imati utjecaj na ekspresiju susjednih gena, koji su posljedično pridonijeli ljudskoj evoluciji.[21]U gornjem citatu, autor pravi razliku između kodirajućih gena (tj. onih koji stvaraju proteine) i nekodirajućih gena - koji ne stvaraju proteine, već umjesto toga reguliraju aktivnost kodirajućih regija.
Da upotrijebimo analogiju, kodirajući geni su poput glazbenika koji, umjesto da proizvode zvuk, proizvode proteine, koji su temeljni građevni blokovi životnih oblika. Nekodirajući geni igraju još temeljniju ulogu; oni su poput dirigenta orkestra koji, umjesto da upravlja glazbenicima, usmjerava[22] ekspresiju kodirajućih gena.
Kao što je prikazano na gornjoj ilustraciji, slučajno ili ne, većina virusnih sekvenci integrirana je[23] u naše nekodirajuće gene, dok su vrlo rijetke u kodirajućim regijama[24].
Sada kada znamo nešto više o kodirajućim i nekodirajućim regijama, vratimo se na pojavu ljudi i razjasnimo razlog zašto su virusi vjerojatni uzrok razlika između ljudi i drugih hominida (čovjekolikih majmuna).
- Razlika u genomu između čovjeka i čimpanze je samo 0,5% u aktivnim kodirajućim regijama[25]. Dakle, morfološke (također poznate kao fenotipske) razlike moraju potjecati iz nekodirajućih regija.
- U nekodirajućim regijama (upravitelji orkestra), najaktivnije[26] sekvence DNA nazivaju se LTR (engl. Long Terminal Repeat) i virusnog su podrijetla.[27]
- Od 19 testiranih LTR-ova u genomima ljudi i drugih velikih majmuna, 17 (~90%) ih je bilo specifično za ljude.[28]
Primijetite da utjecaj virusa na ljudski genom i njegovu ekspresiju nije prestao s razlikom između ljudi i drugih velikih majmuna. Od tada virusi značajno oblikuju ljudsku DNK:
[...] nevjerojatnih 30 posto svih prilagodbi proteina od razilaženja ljudi sa čimpanzama potaknuto je virusima.[29]Ne samo da se virusi smatraju uzrokom pojavljivanja ljudi (genus homo), nego se pojavljivanje cijele taksonomske obitelji (hominida) - kojoj pripadaju zajedno sa sedam drugih postojećih vrsta čovjekolikih majmuna[30] - također pripisuje virusima:
Hughes i Coffin upotrijebili su filogenetsku i sekvencijsku analizu kako bi sugerirali da su ljudski endogeni retrovirusi možda inducirali velike delecije, duplikacije i preslagivanje kromosoma u evoluciji ljudskog genoma. Prema mišljenju genetičara Eugena Sverdlova, ti su virusi odigrali značajnu ulogu u evoluciji i divergenciji hominida.[31]Jedan od dokaza koje je pružio Sverdlov za povezivanje divergencije hominida s aktivnošću retrovirusa je upadljivo pojavljivanje retrovirusa u genomima domaćina u vrijeme kada su se čovjekoliki majmuni (hominidi) odvojili od drugih majmuna:
Neki HERV-ovi su se pojavili u genomu prije više od 30 MG, dok su se drugi pojavili relativno nedavno, otprilike u vrijeme divergencije loza hominida i majmuna.[32] [33]Pojava placentnih sisavaca kojima pripada obitelj hominida također je povezana s genomskom integracijom virusnih sekvenci[34].
Slučajno ili ne, najraniji fosil placentnog sisavca datira do prije 66 milijuna godina, točno u vrijeme izumiranja u razdoblju krede i paleogena. Fosil pripada vrsti Protungulatum donnae[35].
Taksonomska potklasa koju čine placentni sisavci daleko je najzastupljenija od tri podklase sisavaca s gotovo 4000 vrsta[36] koje nude široku morfološku raznolikost od šišmiša do kitova.
Sve do pojave posteljičara, reproduktivne strategije bile su zasnovane na polaganju jaja. Posteljičari su donijeli niz velikih inovacija: naravno posteljicu i maternicu, ali i deaktivaciju imunološkog sustava majke protiv fetusa i zaštitu od infekcija fetusa koji je praktički lišen ikakvog imuniteta. ERV igraju glavnu ulogu u ovim inovacijama:
- Nužni su za morfogenezu placente[37]
- Štite fetus od infekcija srodnim egzogenim retrovirusima[38]
- Štite fetus od majčinog imunološkog sustava[39]
- Kontroliraju ekspresiju genoma embrija tijekom njegovog razvoja[40]
Taksonomska podklasa placentnih sisavaca (euterijskih) pripada taksonomskoj podskupini kralježnjaka koja se pojavila tijekom prethodno opisane kambrijske eksplozije[41] i koincidira i filogenetski[42] i vremenski s pojavom retrovirusa zajedno s njihovim domaćinima kralježnjacima:
[...] novije studije koje datiraju pojavu složenih retrovirusa linija kralježnjaka na ili neposredno prije kambrijske eksplozije od ~500 milijuna godina. Poznato je da su takvi virusi vjerojatno povezani s glavnim evolucijskim genomskim procesima.[43]Ako se vratimo dalje niz filogenetsko stablo koje vodi do ljudi, ponovno otkrivamo istaknutu ulogu koju imaju ERV, ovaj put u stvaranju stanične jezgre[44] i pojavi jedne od tri[45] domene života, eukariota[46] (organizmi čije stanice imaju jezgru): koji obuhvaća gotovo sve makroskopske oblike života, uključujući prethodno opisane kralježnjake.
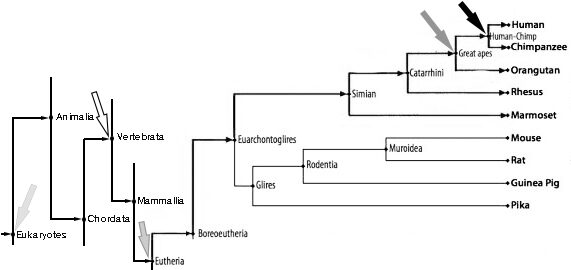
Da rezimiramo, pojava našeg roda (homo), pojava obitelji kojoj pripada (hominidi), pojava potklase kojoj pripada (euterija), potkoljena koje ga sadrži (kralježnjaci) i domena kojoj pripada (eukarioti), svaki je usko povezan s integracijom ERV-a u genome domaćina.
U donjem dijagramu, slijeva na desno, svijetlosiva strelica pokazuje pojavu eukariota, bijela strelica pokazuje divergenciju kralježnjaka od drugih hordata[47], srednje siva strelica označava divergenciju euterije, tamno siva strelica pokazuje divergenciju velikih majmuna (hominida), a crna strelica označava divergenciju ljudi (homo):
Za daljnju ilustraciju temeljne uloge virusa u specijaciji, poučan je primjer sincitina. Sincitin je protein kodiran ljudskim endo-retrovirusom nazvanim HERW1, koji je uključen u specifični razvoj placentnih sisavaca opisanih iznad. Uloga sincitina je toliko kardinalna da je neophodan za razvoj placente:
Genetske studije na miševima utvrdile su da su proteini kodirani sincitinom A (Syna) i Synb, koji su neovisno proizašli iz loze glodavaca iz različitih ERV kopija, potrebni za formiranje dvoslojnog sincitiotrofoblasta mišje placente.[48]Sada, neočekivana značajka sincitina je da su ga sisavci stekli najmanje sedam puta, tijekom različite integracije različitih virusa i svaki put kada je ta integracija u korelaciji s posljedicama događaja specijacije:
[...] preuzimanje sincitina iz različitih virusa dogodilo se neovisno najmanje sedam puta, a svaki se događaj dogodio nakon razilaženja redova sisavaca u kojima su pronađeni.[49]Osim toga, paleovirološke analize su utvrdile da je sincitin-1 koji se nalazi u čovjeku star oko 30 milijuna godina[50], istodoban s krajem eocenskog izumiranja.
Paradoks koji izazivaju gotovo identični genomi koji dovode do različite morfologije nije ograničen na gore spomenuti primjer homo vs čimpanze. Zapravo, kada se uspoređuju jedni s drugima, većina oblika života pokazuje istu proturječnost. To je škakljivo pitanje za darviniste, prema kojima se evolucija odvija kroz inkrementalne genetske promjene, koje dovode do inkrementalnih morfoloških promjena. Očito nije tako:
Rezultati nedavnih istraživanja u evolucijskoj razvojnoj biologiji su da se raznolikost tjelesnih planova i morfologija u organizmima u mnogim vrstama ne odražava nužno u raznolikosti na razini sekvenci gena, uključujući one razvojnog genetičkog alata i druge gene uključene u razvoj. Doista, kao što su primijetili John Gerhart i Marc Kirschner, postoji očit paradoks: "tamo gdje najviše očekujemo pronaći varijacije, nalazimo očuvanje, nedostatak promjene". Dakle, ako promatrana morfološka novost između različitih kladusa ne dolazi od promjena u sekvencama gena (kao što je mutacija), odakle dolazi? Novost može nastati zbog promjena u regulaciji gena uzrokovanih mutacijom.[51]Kao što je detaljno opisano u divergenciji između čovjeka i čimpanze i primjenjivo na gotovo sve oblike života, virusne sekvence mogu i uzrokuju različite ekspresije gotovo identičnih genoma[52], što rješava paradoks izložen u gornjem citatu.
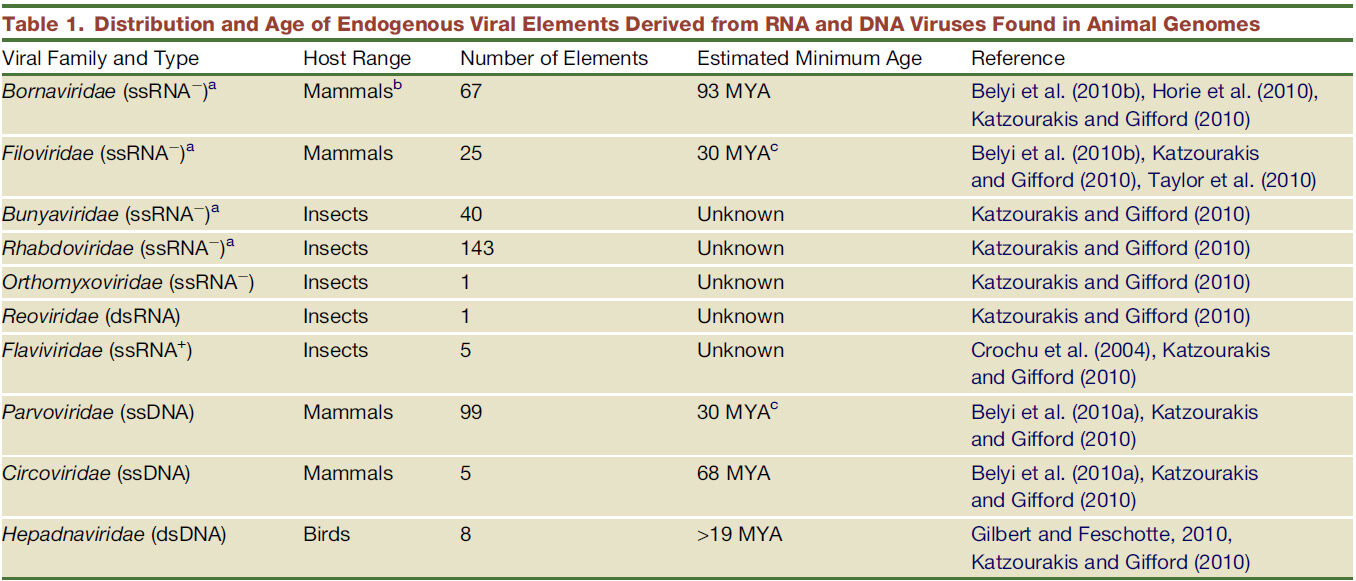
Postoji veliki broj[53] virusa integriranih u genome različitih domaćina, ali njihova integracija nije sustavno datirana. Unatoč tome, ispitivanje znanstvene literature otkriva četiri datuma za integraciju tri različite obitelji virusa u genome sisavaca:
- integracija bornaviridae prije otprilike 93 MG
- integracija circoviridae prije otprilike 68 MG
- integracija filoviridae i parvoviridae, oba datirana na 30 MG:
- izumiranje krajem eocena prije otprilike 34 MG (kometni ciklus #2)
- izumiranje u razdoblju krede-tercijara prije otprilike 66 MG (kometni ciklus #3)
- cenomansko-turonsko izumiranje prije otprilike 93 MG (kometni ciklus #4)
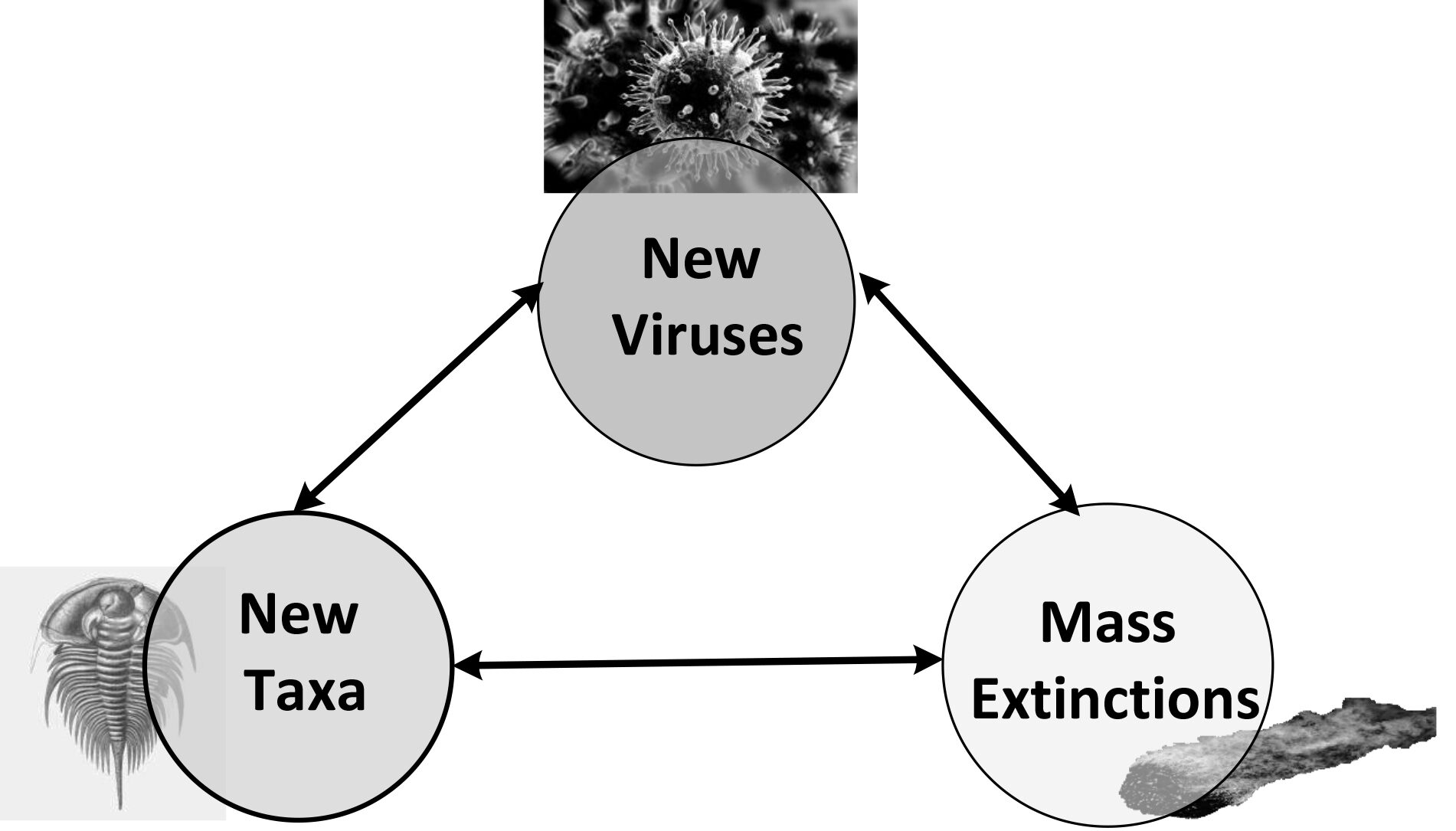
U ovom poglavlju uočili smo tri jake korelacije:
- ERV i nove taksone: ERV su povezane s pojavom potpuno novih sojeva; vrste poput ljudi ili valabija, obitelji poput hominida, potfiluma poput kralješnjaka, pa čak i taksonomske domene eukariota.
- ERV i masovna izumiranja: Integracija novih virusnih obitelji (bornaviridae, circoviridae, filoviridae i baculoviridae) i novih virusa (virusni gen sincitin-1) u genomima domaćina povezuje se s vremenom masovnih izumiranja.
- Novi rodovi i masovna izumiranja: pojava niza novih rodova opetovano se povezuje s masovnim izumiranjima kao što je opširno opisano u 2. dijelu.
Već smo vidjeli dva primjera gdje su ove tri asocijacije dio jedinstvenog dosljednog lanca događaja:
a) divergencija placente, zbog genomske integracije novog virusa tijekom K/T izumiranja,Ali primjeri posteljičara i kralježnjaka nisu neobične iznimke. Znanstvena literatura otkriva druge primjere kada je integracija novih ERV-ova bila ključna u pojavljivanju novih vrsta tijekom ili ubrzo nakon masovnog izumiranja:
b) pojava novih virusa zajedno s njihovim domaćinima kralježnjacima tijekom kambrijske eksplozije.
- Kralježnjaci sa čeljustima su se pojavili nakon izumiranja u ordoviciju i siluru. Analiza njihovih genoma otkriva virusno podrijetlo proteina RAG1 i RAG2 i njihovu središnju ulogu u specijaciji čeljusnih kralježnjaka:
Rezultati podupiru teoriju da su RAG1 i RAG2 nekoć bili komponente transpozibilnog elementa [virusnog podrijetla[57]] i da podijeljena priroda gena za imunoglobulin i T-stanični receptor proizlazi iz umetanja ovog elementa u germinalnu liniju u gen receptor predaka ubrzo nakon evolucijske divergencije čeljusnih i besčeljusnih kralježnjaka.[58]
- Ribe teleostei su se pojavile nakon permsko-trijaskog izumiranja i njihovo pojavljivanje je, barem djelomično, uzrokovano virusnim sekvencama:
Za razliku od genoma sisavaca, genomi teleosta također sadrže višestruke obitelji aktivnih prenosivih elemenata [virusnog podrijetla[59]], koji su mogli igrati ulogu u specijaciji utječući na sterilnost i održivost hibrida.[60]
- Lepidoptera: cijeli red insekata koji sadrži 126 obitelji[61] i 180 000 vrsta uključujući moljce, ose i leptire. Lepidoptera predstavlja 10% vrsta živih organizama[62] i pojavila se prije 200 MG[63] u vrijeme permsko-trijaskog izumiranja bez jasno identificiranih predaka[64]. U isto vrijeme[65] pojavila se nova obitelj virusa: brakovirus koji živi simbiotski u gotovo svakoj vrsti lepidoptera[66].
____________
[1] Palmer, Trevor (2018.), "Perilous Planet Earth Revisited Chronology and Catastrophism", ResearchGate
[2] Givnish, T. J. (2015.), "Adaptive radiation versus 'radiation' and 'explosive diversification': why conceptual distinctions are fundamental to understanding evolution", New Phytol, 207: 297-30
[3] Douglas H. Erwin (2001.), "Lessons from the past: Biotic recoveries from mass extinctions", PNAS, 98 (10) 5399-5403
[4] Cesare Emiliani (1994.), "Evolution--a composite model", Evolutionary Theory, Vol.10, br.6, 299-303
[5] ~ 10-40,000
[6] Erwin, Douglas (2001.), "Lessons from the past: Biotic recoveries from mass extinctions", PNAS 98 (10) 5399-5403
[7] Trevor Palmer (2010.), "Lamarck - The Man, the Myth and the Legacy", C&C Review, str. 40-51
[8] Često se spominju još dva slučaja specijacije u stvarnom vremenu. Prva je srednjoeuropska crnokapa, ptica koja bi "mogla biti na rubu specijacije". Druga je zeba s Galapagosa, čija je analiza genoma pokazala da se ipak radi samo o velikoj kaktusnoj zebi. Pogledajte: Jennifer Skene (2010.), "Evo in the news: Speciation in real time", UC museum of Paleontology
University of Berkeley contributors (2010.), "Understanding Evolution: Speciation in real time", University of Berkeley
[9] Ryan, Frank. (2004.), "Human endogenous retroviruses in health and disease: a symbiotic perspective", Journal of the Royal Society of Medicine, 97(12), 560-565.
[10] Silvia C. Galvan et al. (2015.), "Epigenetics and animal virus infections", Editorial. Frontiers in Genetics.
[11] Desfarges, S., Ciuffi, A. (2012.), "Viral Integration and Consequences on Host Gene Expression", Viruses: Essential Agents of Life, 147-175
[12] Murakami Y. et al. (2005.), "Large scaled analysis of hepatitis B virus (HBV) DNA integration in HBV related hepatocellular carcinomas", Gut 54:1162-1168
[13] Pellett P. E. et al. (2011.), "Chromosomally integrated human herpesvirus 6: questions and answers", Rev Med Virol
[14] Gao J., et al. (2006.), "Epstein-Barr virus integrates frequently into chromosome 4q, 2q, 1q and 7q of burkitt's lymphoma cell line", J. Virol. Methods 136:193-199
[15] Hughes J. F., Coffin J. M. (2001.), "Evidence for genomic rearrangements mediated by human endogenous retroviruses during primate evolution", Nature Genetics. 29 (4): 487-89
[16] Campbell, I. et al. (2014.), "Human endogenous retroviral elements promote genome instability via non-allelic homologous recombination", BMC biology, 12, 74
[17] Ibid
[18] Mighel, A. J. et al. (1997.), "Alu sequences", FEBS Lettre 417, 1-5
[19] Gen je sekvenca DNK ili RNK
[20] Desfarges, S. et al. (2012.), "Viral Integration and Consequences on Host Gene Expression", Viruses: Essential Agents of Life, 147-175
[21] Khodosevich, K. et al. (2002.), "Endogenous retroviruses and human evolution.", Comparative and functional genomics, 3(6), 494-498
[22] Fernandes, J. et al. (2019.), "Long Non-Coding RNAs in the Regulation of Gene Expression: Physiology and Disease", Non-coding RNA, 5(1), 17
[23] De Parseval, N. et al. (2003.), "Survey of human genes of retroviral origin: identification and transcriptome of the genes with coding capacity for complete envelope proteins", Journal of virology, 77(19), 10414-10422
[24] De Parseval (2003.)
[25] Goodman M. (1999.), "The genomic record of humankind's evolutionary roots", Am J Hum Genet 64: 31-39
[26] Boeke J. D., Stoye J P. (1997.), ''Retrotransposons, endogenous retroviruses, and the evolution of retroelements", In Retro- viruses, Cold Spring Harbor Laboratory Press 343 - 435
[27] Lower R, et al. (1996.), "The viruses in all of us: characteristics and biological significance of human endogenous retrovirus sequences", PNAS 93:5177-5184
[28] Khodosevich, K. et al. (2002.), "Endogenous retroviruses and human evolution.", Comparative and functional genomics, 3(6), 494-498
[29] Genetics Society of America (2016.), "Viruses revealed to be a major driver of human evolution: Study tracking protein adaptation over millions of years yields insights relevant to fighting today's viruses", ScienceDaily
[30] 3 vrste orangutana, 2 vrste gorile, 1 vrsta čimpanze i 1 vrsta bonoba. Pogledajte:
Groves, C. P. (2005.), "Mammal Species of the World: A Taxonomic and Geographic Reference (3rd ed.)", Johns Hopkins University Press. str. 181-184
[31] Ryan, Frank (2004.), "Human endogenous retroviruses in health and disease: a symbiotic perspective", Journal of the Royal Society of Medicine, 97(12), 560-565
[32] Sverdlov E. D. (2000.), "Retroviruses and primate evolution", Bioessays;22(2):161-71
[33] Neki od ERV-ova po kojima se razlikuju čovjekoliki majmuni od drugih majmuna su Fc2master i Fc2 env
[34] Chuong E. B. (2013.), "Retroviruses facilitate the rapid evolution of the mammalian placenta", BioEssays : news and reviews in molecular, cellular and developmental biology, 35(10), 853-861
[35] O'Leary et al. (2013.), "The Placental Mammal Ancestor and the Post-K-Pg Radiation of Placentals", Science, 339 (6120): 662-667
[36] Dave Smith (1994.), "Eutheria, the Placental Mammals", University of Berkeley Museum of Paleontology
[37] Mi, S. (2000.), "Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis.", Nature 403:785-788
[38] Benit, L. (2001.), "Identification, phylogeny, and evolution of retroviral elements based on their envelope genes.", J. Virol. 75:11709-11719
[39] Cianciolo, G. J. et al. (1985.), "Inhibition of lymphocyte proliferation by a synthetic peptide homologous to retroviral envelope protein'', Science 230:453-455
[40] Fu, B., et al. (2019.), "Endogenous Retroviruses Function as Gene Expression Regulatory Elements During Mammalian Pre-implantation Embryo Development", International journal of molecular sciences, 20(3), 790
[41] Vidi Drugi dio: Poglavlje 6.: Kambrijska eksplozija života
[42] Aiewsakun, P. et al. (2017.), "Marine origin of retroviruses in the early Palaeozoic Era", Nature Communications 8, 13954
[43] Edward J. Steele, et al. (2018.), "Cause of Cambrian Explosion - Terrestrial or Cosmic?", Progress in Biophysics and Molecular Biology, Volume 136, Pages 3-23
[44] Takemura M. (2001.), "Poxviruses and the origin of the eukaryotic nucleus", Journal of Molecular Evolution, 52 (5): 419-425
[45] The two other domains are the prokaryotes (bacteria) and the archaea (single-celled organism)
[46] Yoshikawa G. et al. (2019.), "Medusavirus, a Novel Large DNA Virus Discovered from Hot Spring Water", Journal of Virology. 93 (8)
[47] Taxonomic phylum including all lifeforms equipped with a backbone amongst other distinctive features
[48] Feschotte, C., Gilbert, C. (2012.), "Endogenous viruses: insights into viral evolution and impact on host biology", Nature Review Genetics 13, 283-296
[49] Katzourakis A. (2013.), "Paleovirology: inferring viral evolution from host genome sequence data", Philosophical transactions of the Royal Society of London, 368(1626), 20120493
[50] Lavialle, C., et al. (2013.), "Paleovirology of 'syncytins', retroviral env genes exapted for a role in placentation", Philosophical transactions of the Royal Society of London, 368(1626), 20120507
[51] Wikipedia contributors (2021.), "Evolutionary developmental biology", Wikipedia
[52] Rebollo R., et al. (2012.), "Transposable elements: an abundant and natural source of regulatory sequences for host genes", Annual Review of Genetics 46 (1): 21-42
[53] Vidi poglavlje: Anteriornost i rasprostranjenost virusa
[54] Harrison, R. L. et al. (2018.), "ICTV Virus Taxonomy Profile: Baculoviridae", The Journal of General Virology, 99 (9): 1185-1186
[55] Wang, M., & Hu, Z. (2019.), "Cross-talking between baculoviruses and host insects towards a successful infection", Philosophical transactions of the Royal Society of London, 374(1767), 20180324
[56] Theze, J. et al. (2011.), "Paleozoic origin of insect large dsDNA viruses", PNAS, 108 (38): 15931-5
[57] Young, G. R., et al. (2012.), "Resurrection of endogenous retroviruses in antibody-deficient mice", Nature, 491(7426), 774-778
[58] Agrawal, A., et al. (1998.), "Transposition mediated by RAG1 and RAG2 and its implications for the evolution of the immune system", Nature 394, 744-751
[59] Young, G. R. et al. (2012.), "Resurrection of endogenous retroviruses in antibody-deficient mice", Nature, 491(7426), 774-778
[60] Volff, J. N. (2005.), "Genome evolution and biodiversity in teleost fish", Heredity 94, 280-294
[61] Capinera, John L. (2008.), "Butterflies and moths" In "Encyclopedia of Entomology", Springer. str. 626-672
[62] Mallet, Jim (2007.), "Taxonomy of Lepidoptera: the scale of the problem", The Lepidoptera Taxome Project
[63] van Eldijk et al. (2018.), "A Triassic-Jurassic window into the evolution of Lepidoptera", Science Advances, 4 (1): e1701568
[64] J.-C. Sohn et al. (2015.), "The fossil record and taphonomy of butterflies and moths (Insecta, Lepidoptera): Implications for evolutionary diversity and divergence-time estimates", BMC Evol. Biol. 15, 12
[65] Jennifer Welsh (2011.), "Oldest Viruses Infected Insects 300 Million Years Ago", Live Science
[66] Gasmi L., et al. (2015.), "Recurrent Domestication by Lepidoptera of Genes from Their Parasites Mediated by Bracoviruses", PLOS Genetics 11(9): e1005470




Komentar: Sljedeće poglavlje: Poglavlje 10.: Iskorjenjivanje ili poboljšanje specifično za vrstu