Komentar: Ovo je 14. poglavlje knjige gosp. Lescaudrona "Masovna izumiranja, evolucijski skokovi i povezanost virusa i informacija".
Prethodno poglavlje: Poglavlje 13.: Rasprostranjenost virusa
Prvo poglavlje: Poglavlje 1.: Masovna izumiranja
Egzogeni virusi
Evolucijska uloga virusa ogromna je u usporedbi s njihovom patogenošću. Od procijenjenih 100 milijuna različitih vrsta virusa spomenutih u prethodnom poglavlju, samo oko 200[1], drugim riječima samo 0,0002% će možda uzrokovati bolesti kod ljudi.
Tih 200 virusa samo je ponekad patogeno, većina nositelja je asimptomatska. Povrh toga, neki od ovih 200 dokumentiranih virusnih "patogena" također mogu izazvati korisne učinke; to je na primjer slučaj kod široko rasprostranjenog herpes virusa i citomegalovirusa.
Doista, i herpes virus i citomegalovirus pokazuju ili štetne ili korisne učinke ovisno o stanju imunološkog sustava domaćina:
Herpesvirusi, kao što su herpes simplex virus i citomegalovirus, dobro su poznati primjeri virusa koji prevladavaju u više od 50% i do 90% ljudske populacije. Dok ovi virusi mogu postati patogeni tijekom stanja imunološke supresije, oni mogu pružiti korisne imunološke podražaje domaćinu u stabilnom stanju[2]Herpesvirus i citomegalovirus nisu izolirani slučajevi. Virus tako učestao kao što je gripa, za koji se donedavno vjerovalo da je isključivo patogen, sada je prepoznat kao koristan jer čini ljude društvenijima[3]. Imajte na umu da su neki subjekti u ovoj studiji imali prosocijalnu korist od virusa bez ikakvih simptoma.
Prednosti virusa su brojne, na primjer, poboljšavaju zaštitu svojih domaćina od bakterijskih infekcija[4], pomažu alternativnim putovima metabolizma ugljika tijekom infekcije[5] i potiču stvaranje proteina toplinskog šoka[6] (HSP) tijekom razdoblja stresa[7]. HSP-ovi su uključeni u temeljne procese kao što su:
HSP su važni čimbenici u regulaciji preživljavanja stanica, diferencijacije i stanične smrti. Nagomilani dokazi pokazuju da neki HSP-ovi sudjeluju ne samo u urođenom staničnom imunitetu, već i u prezentaciji antigena u adaptivnom imunološkom odgovoru. HSP također služe kao potencijalni biomarkeri za neke bolesti.[8]Još više zadivljujući primjer sinergije virus-domaćin dolazi od toga što parazitske ose imaju pripitomljene viruse koji se ne mogu razmnožavati izvan osa. Kada su ubrizgani u plijen, virusi su neutralizirali imunološki sustav domaćina, tako da on ne napada jajašca koja je osa položila unutar tijela domaćina:
Ose tijekom parazitiranja u domaćine ubrizgavaju PDV [polidnaviruse], koji zatim eksprimiraju proizvode virusnih gena koji mijenjaju imunološku obranu domaćina, rast i razvoj kako bi optimizirali uvjete za razvoj osinog potomstva.[9]
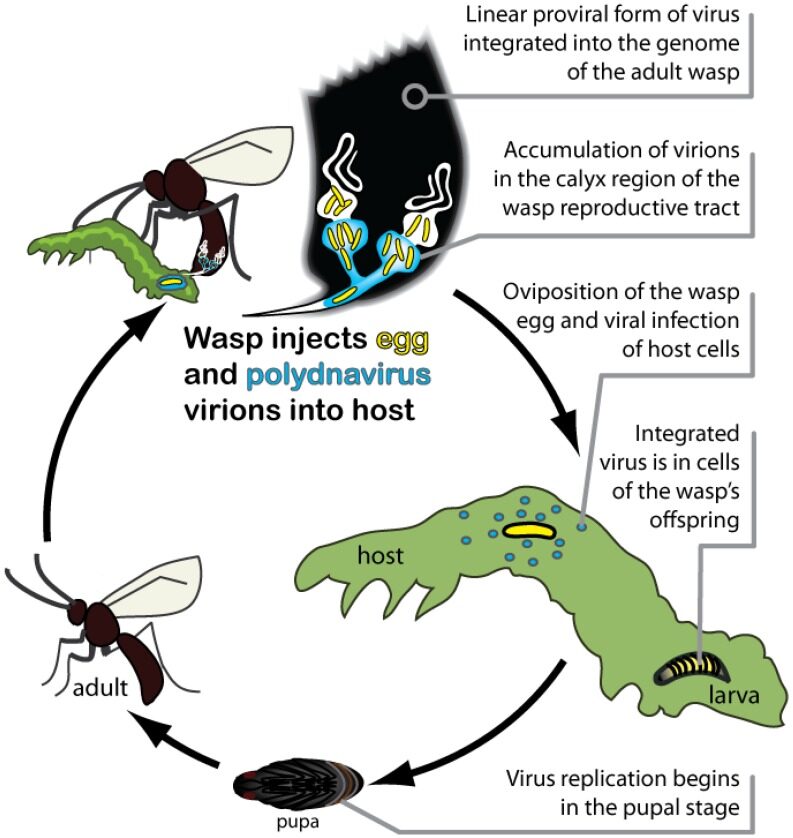
[d'Herelle i] Georgi Eliava uspostavili su fagoterapiju u Tsiblisiju na Institutu Eliava 1936. godine, koji postoji do danas. Do 1200 zaposlenika proizvodilo je tone faga u vršnim razdobljima. Proizvodili su tablete, flastere i liječili 18.000 vojnika u finsko-ruskom ratu 1939. koktelom faga protiv antraksa s 80 posto uspješnosti, što znači izbjegavanje amputacija. Godine 1963. čak 30.000 djece je liječeno, a neki čak i fagom kao profilaktikom[10].Za referencu, neliječeni inhalacijski antraks ima stopu smrtnosti od 80% ili više[11].
Gore navedeni primjeri pokazuju koliko su virusi prevladavajući i vitalni u životinjskim oblicima života, uključujući ljude. Ali isto vrijedi i za biljke:
virusi općenito nisu uključeni u popise korisnih mikroba. Nedavna istraživanja pokazala su da oni također mogu igrati važne i korisne uloge u biljkama.[12]Jedna od glavnih svrha virusa koje koriste botaničari je poboljšanje ljepote određene biljke:
Neki od najbolje opisanih korisnih virusa koji su korišteni u biljkama su oni koji povećavaju ljepotu ukrasnog bilja. Virus koji lomi tulipane bio je prvi na dugom popisu prekrasnih virusa, ali mnoge druge cijenjene ukrasne biljke duguju svoju vrijednost, barem djelomično, virusima koji ih zaraze[13].

[virusi] sudjeluju u prijenosu tolerancije na sušu, niske i vruće temperature tla [...] povećava njihovu vrijednost ili potencijal rasta ili smanjuje potrebu za upotrebom kemijskih gnojiva ili pesticida.[14]Kao i u ljudskom genomu, virusi su već dugo prisutni u genomu biljaka:
Studije o bioraznolikosti virusa pokazuju da su biljke zaražene brojnim virusima koji nemaju vidljivih loših učinaka na svoje domaćine [...] Ovi virusi imaju vrlo duge odnose sa svojim biljnim domaćinima, prenose se vertikalno možda tisućama godina, što snažno implicira pozitivnu interakciju.[15]Endoretrovirusi
Iako je popis dobrobiti koje egzogeni virusi pružaju svojim domaćinima znatan, to je ništa u usporedbi s ERV-ovima.
Prethodno smo vidjeli ključnu ulogu koju igraju ERV-ovi u pojavljivanju niza novih složenih taksona: valabija, ljudi, čovjekolikih majmuna, kralježnjaka, eukariota, kralježnjaka s čeljustima, riba koštunjača Lepidoptera i naravno posteljičara.[16]
Za potonje smo vidjeli kako su ERV bili pokretači pojavljivanja posteljičara, uključujući gotovo sve sisavce. Prije toga reproduktivne strategije temeljile su se na polaganju jaja.
Kao većina egzogenih virusa, ERV ne uzrokuju bolesti:
Većina ERV sekvenci stekla je brojne mutacije tijekom vremena i stoga nemaju potencijal za kodiranje proteina ili potencijal za stvaranje zaraznih virusnih čestica.[17]Ali činjenica da brojne virusne sekvence pronađene u našoj DNK nisu patogene ne znači da su beskoristan arhaizam. Zapravo njihova integracija ERV-ova u genom domaćina pruža prednosti:
Stoga se čini da HERV-ovi sadrže još uvijek aktivne gene, koje je domaćin najvjerojatnije potkopao u svoju korist i treba ih se smatrati pravim ljudskim genima.[18]ERV-ovi su dio onoga što se nazivalo "junk DNK"[19], koji se desetljećima smatrao beskorisnim DNK-om pohranjenim tijekom "evolucijske selekcije". Ova vrsta DNK predstavlja oko 90%[20] našeg genoma. Ali sada se zove nekodirajuća DNK jer je moderna genomika otkrila da neželjena DNK uopće nije nekodirajuća. Jedan glavni primjer je "genska pustinja":
Genske pustinje su regije genoma koje su lišene gena koji kodiraju proteine [...] Izvorno se vjerovalo da sadrže "junk" DNK zbog svoje nesposobnosti stvaranja proteina, genske pustinje su od tada povezane s nekoliko vitalnih regulatornih funkcija, uključujući distalno poboljšanje i konzervatorsko nasljeđivanje. Stoga se sve veći broj rizika koji dovode do nekoliko velikih bolesti, uključujući nekoliko vrsta raka, pripisuje nepravilnostima pronađenim u genskim pustinjama.[21]Osim toga, općenito je istinito uvriježeno mišljenje da su ERV-ovi nekodirajući, ali ipak postoje iznimke, na primjer poznato je da HERV-K[22] kodira HDTV[23].
Od 500 env gena[24], 16 može kodirati proteine i obilno se prepisuju u ključnim organima poput mozga, štitnjače ili nadbubrežne žlijezde:
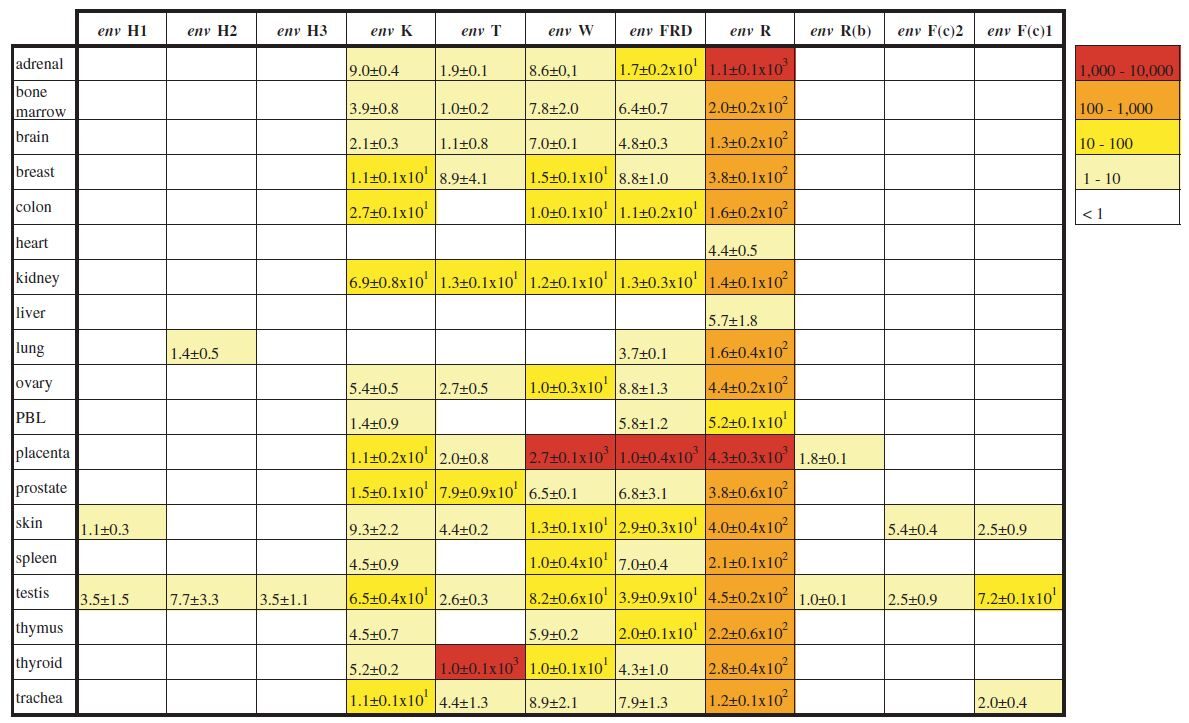
Detaljna studija podfamilije HERV-K (HML2) pokazuje da je 6 (17%) od 35 pregledanih kopija pune dužine prošlo kroz neki oblik NAHR-a [vrsta rekombinacije] nakon umetanja, unatoč relativno nedavnom podrijetlu (<20 prije milijuna godina). S obzirom na to da ova podfamilija čini minijaturni udio (<<1%) ljudskih ERV-ova, ovi podaci naglašavaju potencijalno dalekosežan doprinos ERV-ova remodeliranju arhitekture genoma tijekom dugog vremenskog razdoblja.[36]Unatoč nedavnom pojavljivanju genomike, već postoje brojni primjeri korisnih učinaka izazvanih endogenim virusima, na primjer ERV igraju temeljnu ulogu u zaštiti domaćina od tekućih epidemija:
[ERV] podržavaju antivirusni imunološki odgovor putem brojnih mehanizama. To uključuje poboljšanje staničnih senzornih puteva, regulaciju ekspresije virusnog gena, blokadu ulaznih receptora i izravnu restrikciju sastavljanja viriona.[25]Još jedan primjer blagotvornog učinka induciranog ERV-ima je njihova uključenost u regulaciju ekspresije korisnih kodirajućih gena:
"1996. Roy J Britten s Kalifornijskog instituta za tehnologiju uspio je navesti deset primjera u kojima su endogene retrovirusne sekvence pomogle regulirati ekspresiju korisnog gena. Sedam od deset primjera bili su ljudski.[26]ERV su uključeni u otkrivanje i borbu protiv raka:
Citotoksične T stanice i prirodne stanice ubojice važni su čimbenici nadzora tumora. Naoružani su granzimom i perforinom za izravno ubijanje tumorskih stanica. Nedavna studija koja je koristila skup od 66 ERV-ova kao referencu pokazala je da je 8 od 66 ERV-ova u pozitivnoj korelaciji s ekspresijom granzima i perforina u tkivima raka dojke, što ukazuje na potencijalnu ulogu ERV-a u imunološkom nadzoru[27].ERV su također neophodni za razvoj embrija od najranije faze:
"[...] kada je Corrado Spadafora [...] primijenio lijek protiv reverzne transkriptaze u ovoj vrlo ranoj fazi embriogeneze kod miša, sav razvoj je prestao u fazi četiri stanice. Čini se da endogeni retrovirusi igraju vrlo dalekosežnu, iako potpuno nepoznatu ulogu u ovoj ranoj fazi embriogeneze sisavaca[28]Možda temeljna uloga koju igraju ERV-ovi u morfogenezi, kao što je naglašeno u gornjem citatu, objašnjava zašto su virusi također igrali ključnu ulogu u onome što se može smatrati najvećim evolucijskim skokom, naime u prijelazu s jednostaničnih organizama na višestanične:
Sve poznate molekule stanične fuzije su virusnog podrijetla što sugerira da su bile od vitalne važnosti za međustanične komunikacijske sustave koji su omogućili višestaničnost. Bez sposobnosti stanične fuzije mogle su se formirati kolonije, ali nešto približno složeno kao što je spužva ne bi bilo moguće.[29]Gore navedeno pokazuje prevalenciju virusa u našem genetskom kodu i vitalnu ulogu koju imaju. Ova perspektiva daje drugačiji pogled na tekuće pitanje o tome jesu li virusi oblici života ili ne. Odgovor na ovo pitanje uvelike ovisi o definiciji riječi "život".
Virus je pridonio ljudskom genomu i donio korisne promjene, bakterije i virusi donirali su eukariotskom genomu mnoge ključne gene koji su omogućili evoluciju i specijaciju (Joseph 2009a,b), dok virusi često pružaju značajne koristi domaćinu i često su potkopani od strane domaćin za njegovu dobrobit (Lorenc i Makalowski. 2003; Miller i sur., 1999; Parseval i Heidmann 2005). Dakle, virusi općenito ne razboljevaju domaćina, ali mu pružaju dobrobit. Štoviše, oni ugrađuju gene i regulatorne elemente u genom domaćina i igraju aktivnu ulogu u evoluciji koja vodi do ljudi (Joseph 2009a,b).[30]U svjetlu gornjeg citata, virusi se čine temeljnijima čak i od samog života; oni su nositelji informacija -genetski kodovi- iz kojih proizlazi biološki život. Virusi su više od života; oni su sam izvor života; oni su informacijski prethodnici, pokretači svakog pojedinog oblika života:
Kao što možemo vidjeti iz gornjeg opisa viroma[31], nije pretjerano reći da je virom jezik svakog života na zemlji. Doslovno plivamo u ogromnom moru genomskih informacija koje su bile neophodne za početak i procvat života na ovoj dragocjenoj zemlji i koje još uvijek pokušavaju pomoći svim vrstama da prežive. Matrica organizama koji čine mikrobiom izgradila je viromski tok informacija koji je omogućio prilagodbu i bioraznolikost na planetu. I isti taj viromski tok informacija odgovoran je za izgradnju ljudske vrste.[32]ERV-ovi su uključeni u mnoštvo temeljnih funkcija među kojima su mijenjanje i promicanje gena amilaze, ekspresija gena domaćina ili olakšavanje događaja spajanja:
Među endogenim retroelementima koji zadržavaju određeni stupanj funkcije, mnogi su se prilagodili i postali simbionti u svojoj vrsti domaćina. [...] ERV-ovi koji se razvijaju zajedno sa svojim domaćinima uključuju doprinos ERV pojačivača u mijenjanju specifičnosti tkiva ljudskog gena amilaze[33] od ekspresije specifične za gušteraču do parotide, promičući regulaciju ovog gena specifičnu za žlijezde slinovnice. Domaćini su koristili ERV promotore kao promotore za ekspresiju gena domaćina ili za olakšavanje specifičnih događaja spajanja[34]Drugi primjer je kako su prenosivi elementi (sekvence virusnog podrijetla) uključeni u brojne vitalne procese od imuniteta do regulacije apoptoze (stanične smrti) [35]:
____________________________
[1] Točan broj potencijalno patogenih virusa kod ljudi je točno 219 od 2012. Također primijetite da se svake godine u prosjeku otkriju 3 do 4 potencijalno patogena virusa kod ljudi. Pogledajte:
Woolhouse, Mark et al. (2012). "Human viruses: discovery and emergence." Philosophical transactions of the Royal Society of London. Series B, Biological sciences vol. 367,1604 (2012): 2864-71.
[2] Tokuyama, Maria et al. (2018). "ERVmap analysis reveals genome-wide transcription of human endogenous retroviruses". PNAS, 115 (50) 12565-12572;
[3] Reiber C. et al. (2010) "Change in human social behavior in response to a common vaccine". Ann Epidemiol. 20(10):729-33.
[4] Sherman LA, Pauw P. (1976) "Infection of Synechococcus cedrorum by the cyanophage AS-1M. II. Protein and DNA synthesis". Virology.;71(1):17-27
[5] Sullivan MB et al. (2005) "Three Prochlorococcus Cyanophage Genomes: Signature Features and Ecological Interpretations" PLOS Biology 3(5): e144
[6] Ključni proteini uključeni u savijanje, transport i sastavljanje proteina. HSP su također uključeni u apoptozu i imunološki odgovor.
[7] Wan, Q. et al. (2020). "Stress proteins: the biological functions in virus infection, present and challenges for target-based antiviral drug development". Sig Transduct Target 5, 125
[8] Ibid
[9] Burke, G. R. et al. (2012). ''Polydnaviruses of Parasitic Wasps: Domestication of Viruses To Act as Gene Delivery Vectors''. Insects, 3(1), 91-119.
[10] K. Moelling (2020) "Viruses More Friends than Foes" Electroanalysis 32, 669.
[11] FDA Editors (2018) "anthrax" FDA
[12] Roossinck, M.J. (2015) "Beneficial viruses for crops" Molecular Plant Pathology 16: 331-333.
[13] Ibid
[14] Ibid
[15] Roossinck, M.J. (2012) "Plant virus metagenomics: biodiversity and ecology" Annu. Rev. Genet. 46, 357-367
[16] Pogledajte poglavlje ''Enigma specijacije''
[17] Tokuyama, Maria et al. (2018) "ERVmap analysis reveals genome-wide transcription of human endogenous retroviruses". PNAS, 115 (50) 12565-12572
[18] de Parseval N. et al. (2005) "Human endogenous retroviruses: from infectious elements to human genes". Cytogenet Genome Res. 110(1-4):318-32
[19] TR, ed. (2005) "The Evolution of the Genome" Elsevier. pp. 29-31
[20] Ponting, C.P. (2011) "What fraction of the human genome is functional?" Genome Research. 21 (11): 1769-76
[21] Ovcharenko, Ivan et al. (2004) "Evolution and Functional Classification of Vertebrate Gene Deserts" Genome Research 15 (1): 137-145
[22] Boller K. et al. (1993) "Evidence that HERV-K is the endogenous retrovirus sequence that codes for the human teratocarcinoma-derived retrovirus HTDV".Virology. 196(1):349-53
[23] Virusne čestice dobivene ljudskim teratokarcinomom
[24] Geni virusnog porijekla
[25] Srinivasachar Badarinarayan S., Sauter D. (2021) "Switching Sides: How Endogenous Retroviruses Protect Us from Viral Infections" J Virol. 95(12):e02299-20
[26] Ibid
[27] Tokuyama M et al. (2018) "ERVmap analysis reveals genome-wide transcription of human endogenous retroviruses". PNAS 115:12565-72
[28] Ibid
[29] Wikipedia contributors (2021) "Multicellular organism" Wikipedia
[30] Wickramasinghe, 2013
[31] Skup virusa koji su povezani s određenim ekosustavom
[32] David Skripac (2021) "Our Species is Being Genetically Modified: Humanity's March Toward Extinction?" Global Research
[33] Enzim koji pretvara škrob u šećere
[34] Eiden M. V. (2008) "Endogenous retroviruses--aiding and abetting genomic plasticity" Cellular and molecular life sciences 65(21), 3325-3328
[35] Lorenc, Anna et al. (2003) "Transposable Elements and Vertebrate Protein Diversity" Genetica 118. 183-91. 10.1023
[36] Feschotte, C., Gilbert, C. (2012) "Endogenous viruses: insights into viral evolution and impact on host biology" Nat Rev Genet 13, 283-296



Komentar: Sljedeće poglavlje: Poglavlje 15.: Okolina i/ili klice?